생동성 시험은 복제약이 오리지널 의약품과 동일하다는 점을 입증하기 위한 시험으로 제약사가 제네릭을 출시하기 위해서는 반드시 거쳐야 한다.
평가원에 따르면 생동성 시험 승인 건수는 지난 2015년 201건으로 정점을 찍은 후 2016년 123건, 2017년 106건으로 꾸준히 줄고 있는 추세다. 평가원 측은 “여러 제약사가 공동으로 생동성 시험을 진행하거나 수익성이 높은 제품을 공동개발하는 방법 등을 도입하며 건수가 감소 추세에 있다”며 “특히 지난해의 경우 2018년 만료되는 신약 재심사 및 특허 대상 품목이 감소한데 따라 예년 대비 큰 폭으로 줄었다”고 설명했다. 실제 올해 재심사나 특허가 만료돼 제약사들이 제네릭을 출시할 수 있게 되는 품목은 총 6가지 성분(재심사 만료 2성분, 특허 4성분)에 그친다. 2017년도 총 19개 성분이 재심사 및 특허 만료된 것과 비교해 30% 수준이다.
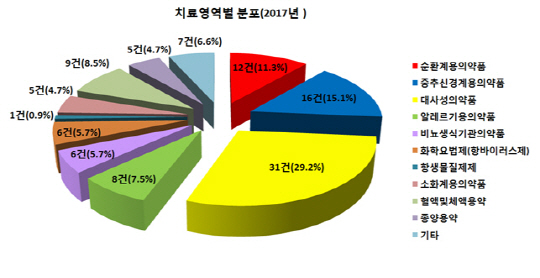
치료 영역별 복제약 개발 동향을 보면 당뇨치료제 등 대사성 의약품과 치매 등 중추신경계의약품, 고혈압 약 등 순환계의약품의 개발 추세가 지속하고 있다. 지난해 가장 복제약 개발이 활발했던 약품은 당뇨병성 다발성 신경염 치료제 ‘덱시드정(성분명 알티옥트산트로메타티민염)’으로 총 13건에 달했다. 2017년 재심사가 만료된 당뇨병치료제 트‘라젠타(성분명 리나글립틴)’의 개발도 이어지고 있어 지난해 당뇨치료제 관련 생동성 시험 승인 건수만 총 31건(29.2%)에 달했다. 이어 치매 치료제 등 중추신경계용 의약품 관련 생동성 시험은 총 16건(15.1%), 고혈압 약 등 순환계용의약품은 12건(11.3%)이 승인받은 것으로 조사됐다.
식약처 측은 “앞으로도 제네릭의약품 개발이 재심사 또는 특허만료 예정 의약품을 중심으로 이루어지고 식생활의 서구화, 고령화 등으로 당뇨병 등 만성질환 치료제가 지속적으로 활발히 개발될 것으로 전망한다”고 밝혔다.
/김경미기자 kmkim@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 kmkim@sedaily.com
kmkim@sedaily.com







































