글로벌 제약사들이 중국 시장에 최신형 의약품을 잇따라 내놓으며 시장 선점에 나서고 있다. 중국 정부가 고령화와 소득향상으로 증가하는 의약품 수요를 자국 기업의 기술력으로 감당할 수 없다는 판단하에 인증절차를 대폭 완화해 해외 제약사들의 진출을 독려한 덕분이다.
5일 니혼게이자이신문에 따르면 중국 식품의약품감독총국(CFDA)은 지난 2016년에 이어 지난해에도 임상시험 제도와 판매허가 심사 문턱을 대폭 낮춰 다수의 글로벌 제약사들이 신약 출시 허가를 받아냈다. 영국 아스트라제네카는 폐암 치료제 타그리소의 판매승인을 지난해 3월 취득했다. 한발 더 나아가 아스트라제네카는 암·순환기질환 약물의 현지 개발을 위해 지난해 11월 중국에 합작회사까지 설립했다. 영국 글락소스미스클라인과 미국 길리어드도 최근 연이어 신약 출시 허가를 받는다는 소식이 전해졌다.
그동안 CFDA는 외국에서 공인된 임상시험 자료가 있어도 현지 판매허가를 위해 중국 내 임상을 다시 실시하도록 해 시간이 많이 걸린다는 지적이 나왔다. 이에 따라 제도개선으로 지난해 10월 기존 데이터에 중국인이 일정 수 이상 포함된 경우 임상시험을 통과한 것으로 절차를 간소화했다. 여기에 5년 이상 걸리던 판매허가 신청 기간을 절반으로 단축했다. 신문은 두 제도를 모두 이용하면 현지에서 신약 개발부터 출시까지 최장 3년을 단축할 수 있다고 분석했다.
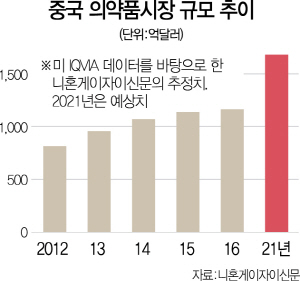
중국 시장에 최신형 의약품 출시가 잇따르는 것은 중국 정부와 글로벌 제약사의 이해관계가 맞이 떨어졌기 때문이다. 중국 정부 입장에서는 중국 제약회사가 국내 수요에 맞춰 고급 신약을 제작하는 데 기술력이 부족해 이를 해외 제약사들에 맡기려는 것이다. 글로벌 제약사는 중국 시장의 성장 가능성을 높이 봤다. 미국 컨설팅 기업인 보스턴컨설팅그룹(BCG)은 2016년 1,167억달러(약 126조원)였던 중국 의약품 시장 규모가 오는 2021년 1,700억달러로 늘어 높은 수익성이 기대된다고 밝혔다. 중국 정부는 부족한 수요를 충당하고 글로벌 제약사는 신규 시장을 개척해 ‘윈윈’하는 셈이다.
다만 신문은 중국 특유의 ‘짝퉁’ 의약품 문제가 발생할 수 있어 해외 제약사의 진출 독려가 성공하기 위해서는 지적재산권 제도 보강 등의 과제를 해결해야 한다고 지적했다. /변재현기자 humbleness@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >