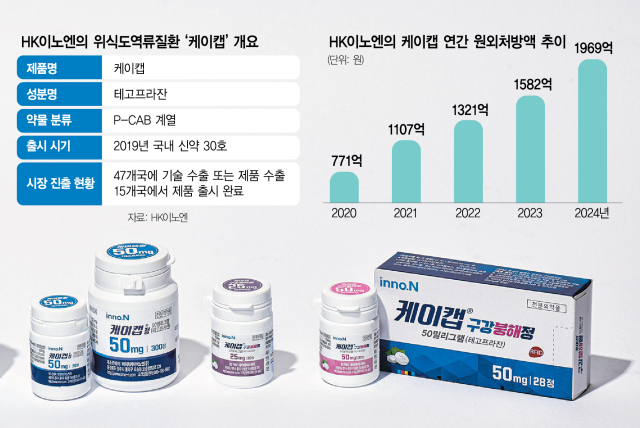
HK이노엔(195940)의 위식도 역류질환 신약 ‘케이캡’이 미국 3상 임상시험에서 성공적인 결과를 얻었다. 기존 치료제 대비 통계적 우월성을 입증해 미국 시장 진출에 필요한 핵심 데이터를 확보한 것이다. 회사 측은 이 데이터를 바탕으로 올 4분기 미국 식품의약국(FDA)에 의약품 허가를 신청할 계획이다.
HK이노엔의 미국 파트너사 세벨라는 23일(현지 시간) 미국 위식도 역류질환자를 대상으로 진행한 테고프라잔(케이캡의 미국명) 3상 임상시험에서 경쟁약에 비해 우수한 결과를 얻었다고 주요 결과(톱 라인)를 발표했다.
미국 임상은 2021년 HK이노엔과 기술 계약을 맺은 미국 파트너사 세벨라의 소화기 의약품 전문 계열사 브레인트리가 진행하고 있다. 케이캡은 HK이노엔이 개발한 30호 국산 신약으로, 국내에는 2019년 출시돼 2024년까지 누적 7054억 원의 처방실적을 기록했고 미국 진출을 추진하고 있다.
테고프라잔은 미란성 식도염(EE)및 비미란성 위식도 역류질환(NERD) 임상 모두에서 1차, 2차 평가지표를 충족했다. 특히 미란성 식도염 임상에서는 전체 환자군과 중등도 이상의 식도염 환자군 모두의 2주·8주차 치유율이 경쟁 약물인 PPI 계열(란소프라졸)에 비해 통계적 우월성을 입증했다. 펠리스 슈놀-서스먼 와일 코넬 의과대학 임상 의학 교수는 “테고프라잔의 미란성 식도염 데이터는 P-CAB 계열이 PPI보다 우수한 효과를 나타낼 수 있음을 보여줬다"며 "테고프라잔이 다른 약제에 비해 이점을 제공할 수 있음을 시사한다”고 말했다. 프라티크 샤르마 캔자스 의과대학 교수(미국소화기내시경학회장)는 “가슴 쓰림과 위산 역류가 위식도 역류질환의 주요 증상이지만 그동안 가슴 쓰림 증상 개선만 이야기해왔다”며 “이전 약물 치료 연구들은 P-CAB계열의 테고프라잔과 달리 위산 역류 증상 감소를 보여주지 못했기 때문”이라고 했다. 기존 치료제에 비해 테고프라잔의 이점이 분명하다는 의미다. 이번 임상 3상 결과는 국제 학술지에 투고하고 주요 소화기학회에서 발표될 예정이다.
이날 임상결과 소식이 알려지자 HK이노엔 주가는 코스닥 시장에서 가격제한폭까지 치솟았다. 경쟁약 대비 우월성이 확인된 만큼 미국에서 품목허가를 받을 가능성이 높아졌기 때문이다. 실제 세벨라는 올 4분기에 미국 FDA에 미란성 식도염 및 비미란성 위식도 역류질환 적응증을 포함한 신약허가신청(NDA)을 제출할 계획이다. 시장에서는 미국 시장에 진출할 경우 연간 1조 원 이상의 매출 달성이 가능할 것으로 보고 있다. 미국의 소화성 궤양용제 시장은 2023년 기준 약 4조 원 규모다. 시장조사기관 이벨류에이트파마는 경쟁 약물인 ‘보노프라잔’(미국 제품명 보퀘즈나)이 2030년 글로벌 매출을 19억 달러(약 2조 7000억 원)를 달성할 것으로 예상했고, 보노프라잔의 미국 유통사 패썸은 미국 내 최대 매출을 30억 달러(약 4조 원)로 내다봤다.
곽달원 HK이노엔 대표는 “세계 최대 의약품 시장인 미국에서 성공적으로 3상 임상시험을 마쳤다"며 “세벨라 등과 긴밀하게 협업해 미국 등 글로벌 시장에서 위식도 역류질환 치료의 새로운 표준으로 자리잡을 수 있도록 최선을 다할 것”이라고 했다.
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >